
题目1
某氧化反应器出口气体温度300℃,用于废热锅炉回收热量产生低压蒸汽。已知气体流量为
20000kg/h,出废热锅炉的温度为150℃,气体的平均比热容为1226J/(kg·℃),锅炉给水
温度为120℃,压力为0.5MPa(G),焓值为505kJ/kg;产生的蒸汽压力为0.3 MPa(G),焓
值为2738 kJ/kg,若不计热损失,则产生的蒸汽量(kg/h)应为下列哪个数值?
(A)1343 (B)1647 (C)10980 (D)1134
解答1
两个设备反应器和废热锅炉。反应器的气体用于废热锅炉回收热量,产生蒸气。所以这是一个能量平衡的问题。
供热的气体总供热量
![]()
锅炉给水被加热后,一般会产生两个效果
- 水本身被加热
- 部分水被蒸发为低压蒸气
但此处仅有蒸气会从锅炉流出,从热量平衡的角度来看,水本身被加热可以认为是热损的一部分,因此将其忽略
进而得到蒸汽量![Rendered by QuickLaTeX.com \[ F=Q / \Delta H =1226*20000*(300-150)/(2738-505)/1000 = 1647.1 kg/h\]](https://www.cryogeny.cn/wp-content/ql-cache/quicklatex.com-d74c64644d6ab36531837b2095053216_l3.png)
选B
题目2
用乙烯氧化生产环氧乙烷的反应过程,进料乙烯物流中乙烯和乙烷的含量分别为
99.96vol%和0.04vol%,与纯氧进行反应生成含环氧乙烷的反应气,用水完全吸收掉反应气
中产物环氧乙烷后,反应气一部分循环回反应器,一部分放空以防止反应系统中的惰性组分
及乙烷积累,该过程图示如下:
已知乙烯进料量为10000kg/h,循环气中含乙烯25vol%,致稳氦气65 vol%,乙烷3.5 vol%,
其它6.5 vol%,问放空气量是下列哪个数值?
提示:乙烯摩尔质量28.05g/mol,乙烷摩尔质量30.07g/mol
(A)4.74mol/h (B)114.3kg/h (C)4.074kmol/h (D)11.43kg/h
解答2
进料混合物的摩尔质量 ![]()
进料的摩尔体积 ![]()
乙烷不参与反应,其摩尔体积为 ![]()
由于放空气体的组成和循环气一样,并且和氧化反应吸收后的剩余气体组成一样,由此可以知道反应吸收完成后剩余的气体总体积流量为 0.1426/3.5% =4.074kmol/h
选C
此题目略有瑕疵,最后的4.074kmol/h实际包含了最终实际放空量和循环量
题目3
用一台蒸发器浓缩15wt%的NaOH 碱液,蒸发器入口温度为20℃,器内沸点温度为70℃,
70℃时水的焓值为266kJ/kg。用蒸汽加热,各物流参数如下图所示: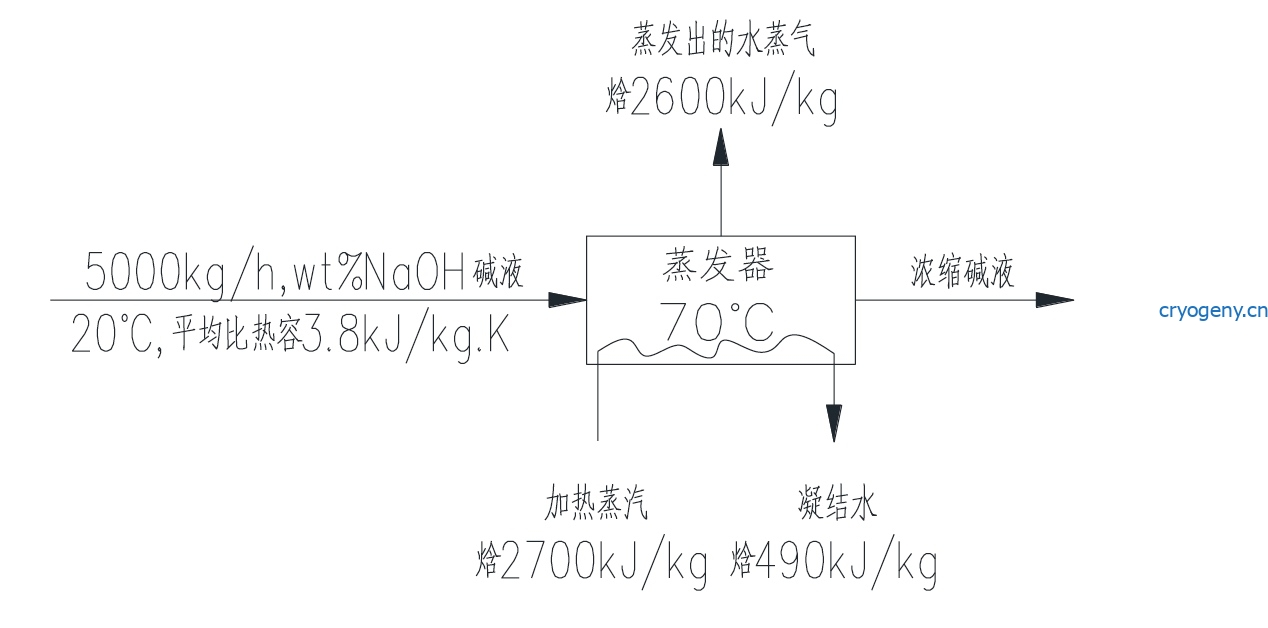
加热蒸汽量为2750kg/h,热损失量为30×![]() kJ/h,则蒸发器出口浓缩碱液NaOH 的含量(wt%)
kJ/h,则蒸发器出口浓缩碱液NaOH 的含量(wt%)
为下列哪个数值?
(A)20.4 (B)23.5 (C)25.6 (D)27.8
解答3
此题为热量平衡和质量平衡
加热蒸汽供热总量为 ![]()
此热量一方面用来蒸发水,另一方面将碱液的温度从20提升到70度, 同时特别留意被蒸发的水的温度也被从20度加热到70度
假设蒸发水的质量为m,则![]()
5777500 = m(2600-266) +3.8(5000-m)50 +4.1850m
5777500-950000 = 2334m-190m+209m
m= 2051.6 kg/h
根据NaOH质量守恒
500015%/(5000-2051.6) =25.44
选C
实际上,由于上述计算过程中把被蒸发的水加热过程从碱液中剥离出来进行计算,这导致题中给的碱液的平均比热容和计算的假设过程略有偏差,因此答案稍微偏离。
正确的做法是将热量平衡分成两段,第1段为将整体的碱液加热到70°C ,第2段将70°C的水进行蒸发,具体计算过程不再赘述。